PDA Letter 在 今年3月份发表了一篇文章《Challenges in Sterilizing Indirect Product-Contact Surfaces》,文章探讨了在无菌药品生产过程中,对间接接触产品的表面——特别是胶塞锅——进行灭菌及无菌处理时所面临的核心挑战与解决方案。文章引用了一项2023年对全球超过65家公司的调查数据。该调查显示,67%的公司拥有可拆卸的胶塞锅,而剩下的33%则面临胶塞锅不可拆卸或过重难以拆卸处理的困境。

显然,这三分之一的生产商现状与2022年更新的欧盟GMP Annex 1要求存在不符。对于新安装的灌装线,法规期望所有直接和间接产品接触部件都应能拆卸并进行线下清洗灭菌。而对于现有不符合要求的设备,若要实施与Annex 1推荐程序不同的替代方案(如在线手动清洁消毒),则必须通过质量风险管理的工具进行充分论证和合理化。但笔者认为,如果没有特殊原因,没有坚持使用这种生产线来挑战相应法规的必要性。
这里不想系统回顾这篇文章,因为个人经验,在国内的商业化无菌灌装线,基本就没有胶塞锅不可拆卸的情况。但文章一些风险分析角度,仍然有参考价值,可从基础逻辑分析评价胶塞锅或一些间接接触部件的处理风险。
针对离线清洗与灭菌环节,控制的核心在于“验证”与“稳健设计”。清洗过程必须经过严格验证,以确保能有效去除特定的、可能难以清洁的残留物,例如硅化胶塞带来的硅油。其文章强调,对于硅油这类残留,需使用配方化学剂(含表面活性剂等),并基于实验室研究来设计稳健的清洗程序。而灭菌过程,应首选经过验证的湿热灭菌循环,确保达到规定的无菌保证水平。灭菌前的包裹也至关重要,包裹材料(如Tyvek)的选择需基于其蒸汽穿透性、微生物屏障性能、低颗粒脱落特性以及是否便于后续的无菌传递操作。
众所周知,胶塞锅采用可拆卸方案并非意味着风险为零,而是将风险从“在线手工清洁的不确定性与高难度”转移到了“物料在洁净区之间的传递与最终安装环节”。换句话说,风险关注点更应放在“传递”与“安装”这两个可被严格定义、控制和监控的环节。
文章通过风险评估工具清晰地指出,风险主要集中在两个关键阶段:从D级区到C级区的无菌物料传递,以及在灌装线旁的最后拆包与安装。在没有双扉灭菌柜而需要手动移除外层包裹的情况下,是引入微粒和微生物污染的极高风险点。
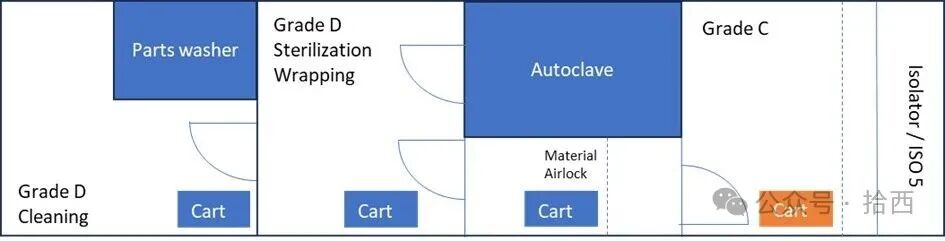
而拆包与安装步骤,特别是在使用隔离器(周边环境为C级)时,由于操作员需要在高洁净度环境附近进行直接操作,任何操作失误或不当技术都可能导致污染物侵入关键区域。因此,整个质量风险管理的重心,就落在了如何对这些已识别的关键步骤实施严格且有效的控制上。
针对这些风险焦点,文章提出了一系列构成行业最佳实践的控制措施与建议。对于物料传递,最理想的解决方案是使用双扉灭菌柜,实现从非洁净区到洁净区的无缝、无菌传递,彻底规避人工干预。若无此设备,则应采用经过验证的包裹方案(如“一个罩子加双层Tyvek灭菌袋”),并在物料气锁间由两名训练有素的操作员在连续层流下,严格执行“移除外层包裹”的传递程序,这被证明比手动消毒外包装更可靠、更可重现。
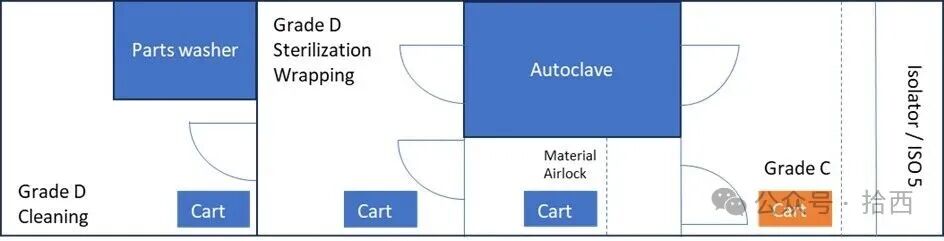
此外,利用隔离器或RABS在生产前执行的自动化生物净化周期,是弥补此过程中可能引入的微生物污染的终极安全保障。即在胶塞锅安装完成后、无菌生产开始前,执行经过验证的隔离器内部生物净化周期,当然,目前最主流的是汽化过氧化氢(VHP/VPHP)系统。

具体操作如下:高压灭菌后,将带有Tyvek 罩的胶塞锅重新放回振动台上,待其他所有设备准备就绪(隔离器关闭)后,戴上隔离器手套,尽可能无菌地取下 Tyvek 罩,然后启动 VHP 循环。
说起来容易做起来不易,对于拆包与安装,必须制定详尽、清晰且易于遵循的标准操作规程,明确规定在划定的预备区、在连续层流下进行操作。操作员需穿戴额外的防护(如口罩、护目镜、特卫强袖套),并严格遵守“四眼原则”,即由另一名操作员进行监督或协助。
最后,整个过程的有效性需要通过各种监控手段来验证,包括在关键区域实施连续的粒子监测,以及定期执行严格的无菌工艺模拟(培养基模拟灌装),以证明从胶塞锅准备到最终产品的整个无菌流程是受控的。
综上所述,在制药行业在日益严格的法规环境驱动下,处理可拆卸胶塞锅的步骤应是经过深思熟虑的风险评估后所达成的技术与管理的共识。同时,期望随着设备设计的更新与技术的进步,这种大体积的间接接触部件能够实现如直接接触部件一样的转运形式,即灭菌后的包裹部件通过连接至灭菌柜的传递舱或端口,直接无菌转移至已生物净化的隔离器内,从而最终降低转移过程带来的风险。
作者:Shengyi
来源:拾西
公众号日期:2025年12月2日
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
